Ziektes ontwapenen met moleculaire lijm

Veel van de op dit moment beschikbare medicijnen zijn niet specifiek genoeg om effectief complexe ziektes zoals kanker, neurodegeneratieve ziektes en diabetes te genezen. Daarnaast vermindert de resistentie voor medicijnen de effectiviteit van bestaande therapieën. Om deze problemen aan te pakken, ontwierp biomedisch ingenieur Eline Sijbesma kleine moleculen die specifieke ziekte-eiwitten ontwapenen door ze vast te plakken aan andere eiwitten. Deze kunnen leiden tot stabielere en effectievere medicatie en bovendien bijdragen aan een nieuwe therapie voor resistente borstkanker, waar op dit moment geen behandeling voor bestaat. Sijbesma verdedigt haar proefschrift op 2 december op de TU/e.
Als je je de cel voorstelt als de kleinste fabriek van het leven, dan zijn de eiwitten de machines in deze fabrieken die al het werk doen. Vergelijkbaar met machines in een productielijn, werken de eiwitten niet in afzondering; ze hebben elkaar nodig om te functioneren. Fysieke interacties tussen eiwitten creëren essentiële signaalnetwerken, waardoor cellen snel en adequaat kunnen reageren op externe signalen. Bij ziekte functioneert vaak een enkel eiwit niet goed, of is te actief. Een medicijn van moleculaire grootte kan dan aan dit ziekte-gerelateerde eiwit binden om de activiteit te corrigeren. Hierdoor kan de normale functie van de eiwitten herstellen. Helaas is deze aanpak niet altijd succesvol en dan weten de zieke cellen alsnog de behandeling te ontlopen.
Twee is beter dan één
Eline Sijbesma, promovenda in de onderzoeksgroep Chemical Biology geleid door professor Luc Brunsveld: “Waarom richten we ons op een enkel eiwit? En niet op het maken van medicijnen die binden aan een complex van twee eiwitten?” Sijbesma’s hypothese is dat als we moleculen kunnen ontwikkelen die de interactie tussen twee eiwitten stabiliseren, we daarmee het ziekte-eiwit vast kunnen te ‘lijmen’ aan een ‘regulatie-eiwit’. Hiermee worden de slechte activiteiten van het ziekte-eiwit tegengehouden. Daarnaast zijn deze moleculen veel selectiever omdat ze alleen binden aan het eiwitcomplex en niet aan twee individuele eiwitten, wat resulteert in minder bijwerkingen.
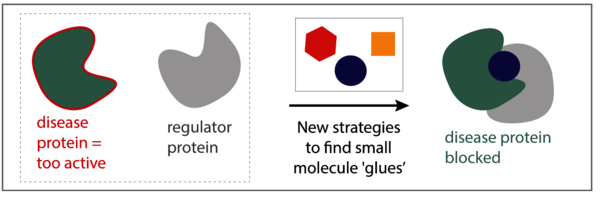
Stevig en sterk
Samen met de University of California San Francisco (UCSF) en de Novartis Institutes for Biomedical Research (NIBR), heeft Sijbesma verschillende strategieën uitgeprobeerd om nieuwe medicijnen te ontdekken. De onderzoekers maakten daarvoor gebruik kleine moleculen (‘fragmenten’) als startpunt. Sijbesma: “We hebben verschillende fragmenten met de gewenste eigenschappen geïdentificeerd en op een slimme manier gecombineerd om één nieuw molecuul te vormen met zelfs nog betere eigenschappen. We hebben laten zien dat het nieuwe molecuul inderdaad tegelijkertijd kan binden aan twee eiwit-partners, wat het eiwitcomplex maar liefst 40 keer sterker maakt.”
Borstkanker
De ontwikkeling van deze ‘moleculaire lijmen’ heeft groot potentieel voor specifieke soorten resistente borstkanker. Bij deze ziekte is vaak sprake van een overactieve receptor (Oestrogeen Receptor α). Huidige medicatie probeert zijn activiteit direct te blokkeren maar deze benadering is niet effectief. In een recente publicatie, bewijst Sijbesma dat het stabiliseren van de interactie van deze receptor met een regulerend eiwit een veelbelovende strategie is. Sijbesma: “Deze receptor staat erom bekend afgeremd te worden door een specifiek eiwit (14-3-3σ). Daarom hebben we moleculaire lijmen ontworpen die de receptor stevig kan ‘vastmaken’ aan dit eiwit en het daarmee inactiveert.”
Meer dan kanker
De belangrijkste innovatie van haar onderzoek vindt Sijbesma het tot stand brengen van het onderliggende biologische concept van een moleculaire ‘lijm’ voor twee eiwitten. Dit kan leiden tot nieuwe werkwijzen in medicijnontwikkeling en de behandeling van verschillende ziektes. Sijbesma: “Deze aanpak is namelijk niet beperkt tot toepassing in borstkanker. In de toekomst kan het bijdragen aan de ontwikkeling van nieuwe therapieën voor ziektes als neurodegeneratie, ontstekingsziekten, taaislijmziekte en diabetes.”
Titel van proefschrift: ‘Stabilization of protein-protein interactions as a drug discovery strategy; fragments as a muse’. Begeleiders: Prof. Luc Brunsveld, TU/e, Dr. Christian Ottmann, TU/e. Partners: University of California San Francisco (UCSF), Novartis Institutes for Biomedical Research (NIBR).