Nieuw inzicht in weefselgroei in synthetische vaten bij nierdialyse
Biomedisch onderzoek onthult verband tussen bloedstroom en buitensporige weefselgroei in dialyse-implantaten voor nierpatiënten.
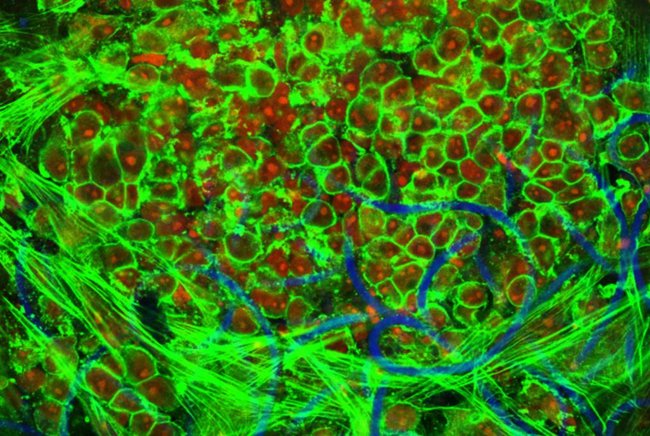
Chronische nierziekte beïnvloedt het leven van miljoenen mensen. Het is een aandoening die wordt gekenmerkt door het verlies van verschillende belangrijke nierfuncties, zoals het verwijderen van toxines uit het bloed. Om dit verlies te compenseren, kan een patiënt een regelmatige dialyse ondergaan om zijn bloed te reinigen, waarvoor in sommige gevallen een kunststof buisje moet worden geïmplanteerd dat op de dialysemachine wordt aangesloten. Dit buisje kan echter geblokkeerd of verstopt raken door onregelmatige celgroei, wat weer een negatieve invloed kan hebben op de dialyse. Onderzoekers van de Technische Universiteit Eindhoven in samenwerking met de Universiteit Maastricht hebben nauwkeurig bestudeerd hoe nieuw weefsel groeit in de buurt van deze buisjes. Het artikel is gepubliceerd in Nature Communications Biology.
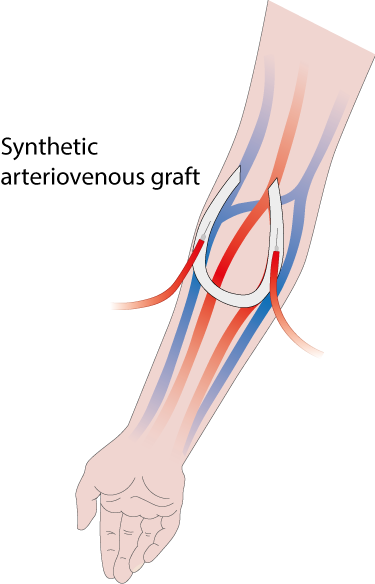
Patiënten met een chronische nierziekte in het eindstadium moeten regelmatig dialyse ondergaan om giftige stoffen uit hun bloed te verwijderen. Tijdens de behandeling stroomt het bloed van de patiënt door een dialyseapparaat, dat fungeert als een kunstnier buiten het lichaam. Voor deze behandeling is een stabiele en betrouwbare toegang tot het bloedcirculatiesysteem van de patiënt nodig. Deze ‘vaattoegang’ wordt via een operatie in het lichaam gebracht.
Bij de procedure worden een slagader (die zuurstofrijk bloed vervoert) en een ader (die zuurstofarm bloed vervoert) in de arm met elkaar verbonden via een synthetische buis die bekend staat als een arterioveneus transplantaat (AV).
"Deze AV-transplantaten werken op zich goed, maar zijn niet zonder problemen," zegt onderzoekster Eline van Haaften. "In de buurt van de ader kunnen de buizen verstopt raken door de groei van overmatige hoeveelheden vaatweefsel. De oorzaak hiervan ligt vermoedelijk in het abnormale stromingsgedrag van bloed in de buurt van de ader."
Specialisatie
Het ontwerpen van synthetische AV-buizen is een specialisatie van de onderzoeksgroep van Carlijn Bouten, hoogleraar bij de faculteit Biomedical Engineering aan de TU/e. Deze buizen hebben een heel bijzondere eigenschap.
Ze zijn namelijk gebaseerd op tijdelijke structuren die in het lichaam worden geplaatst. Deze structuren, die lijken op bouwsteigers, zetten cellen aan om erop te groeien. Het mooie is dat de steigers na verloop van tijd weer door levend weefsel worden geabsorbeerd. "Om te voorkomen dat deze zelfregenererende transplantaten in het lichaam verstopt raken, moeten we beter begrijpen hoe bloed stroomt in de buurt van gezond en onregelmatig vaatweefsel", zegt Bouten.
Een numeriek-experimentele aanpak
Om dit vraagstuk te onderzoeken, kozen de TU/e-onderzoekers voor een numeriek-experimentele aanpak. Ze werkten samen met de groep van Wouter Huberts van de afdeling Biomedical Engineering van de Universiteit Maastricht, die gespecialiseerd is in patiëntspecifieke wiskundige modellen voor klinische besluitvorming.
Eerst gebruikten zij numerieke modellen (ontworpen door Sjeng Quicken) en patiëntgegevens om de biomechanica op het knooppunt van de ader en het transplantaat te analyseren. Vervolgens gebruikten de onderzoekers deze biomechanische gegevens voor in vitro-experimenten, waarbij de groei van vaatweefsel in de buurt van het transplantaat wordt nagebootst.
Om de omgeving in het lichaam zo goed mogelijk te benaderen, kweekten zij een zelfregenererend vasculair transplantaat in een bioreactor die een nauwkeurige controle mogelijk maakte van de door de bloedstroom veroorzaakte spanningen die door het transplantaat worden ervaren. In dit geval ging het om zogenaamde afschuifspanningen, die het weefsel in zijwaartse richting vervormen.
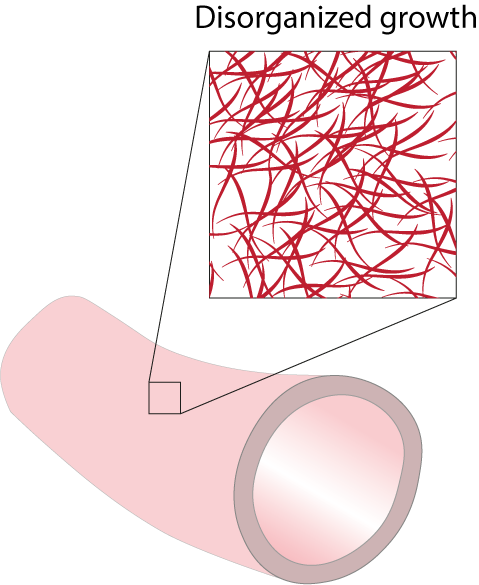
De onderzoekers stelden vast dat pulserende of oscillerende afschuifspanningen niet alleen leiden tot blokkering rond de synthetische buis, maar ook tot buitensporige en chaotische weefselgroei. Het minimaliseren van deze afschuifspanningen zou kunnen helpen om de negatieve effecten die gepaard gaan met overmatige weefselgroei aanzienlijk te verminderen. Ook kunnen de resultaten helpen bij het optimaliseren van het ontwerp van toekomstige regeneratieve transplantaten.
Sterke punten van engineering naar voren
Volgens Carlijn Bouten is dit werk belangrijk omdat het computermodellering combineert met experimenten. “Dit onderzoek laat zien wat onze sterke punten zijn op het gebied van regeneratieve technologie. We hebben experimentele en computationele benaderingen gecombineerd om een belangrijk klinisch probleem in de regeneratieve geneeskunde beter te begrijpen."
En ook onderzoeker Nicholas Kurniawan is enthousiast over de resultaten van het onderzoek: "Dit is een demonstratie van een bottom-up benadering. We hebben patiëntengegevens gebruikt om een computermodel te verfijnen, en vervolgens hebben we de gegevens van het model gebruikt voor onze experimenten. Dit is een krachtige aanpak om de belangrijkste biofysische en mechanobiologische processen te identificeren die we normaal gesproken niet in vivo kunnen monitoren."
Voor Eline van Haaften, die nu bij Philips Healthcare werkt, is deze publicatie een opmerkelijke - het is het laatste paper van haar promotieonderzoek. "Dit onderzoek was eigenlijk het laatste hoofdstuk van mijn proefschrift, dat ik in oktober 2019 verdedigde. Maar toen was het nog niet helemaal klaar om ingediend te worden bij een tijdschrift, omdat er nog wat meer werk verzet moest worden door de teams in Eindhoven en Maastricht. Deze publicatie markeert echt het einde van mijn promotie-reis, en het is een geweldige manier om af te sluiten!"
Volledig artikel: “Computationally guided in-vitro vascular growth model reveals causal link between flow oscillations and disorganized neotissue”, Eline E. van Haaften et al., Nature Communications Biology, (2021), Doi: 10.1038/s42003-021-02065-6.